研究テーマ
当研究室では主に複素環化合物やニトロ化合物を扱った化学を中心にした基礎研究を展開しています。すなわち、他法では入手が困難であった骨格を簡便に構築する方法を開発したり、これまでに報告されていない骨格を新たに合成したりしています。これらの研究を通じて、応用研究に携わる方が使用する道具を提供する役割を果たしています。多様な骨格を簡便にかつ効率良く得ることができれば、医薬、農薬、色素、光学材料などの機能性材料の開発分野で、新たな候補化合物の探索が容易になります。
近年、当研究室で展開している研究のいくつかを紹介します。
1)擬似分子内反応による高効率な反応の開発(詳しくはこちら)
2)簡便な多置換ピリジン合成法の開発(詳しくはこちら)
3)ニトロ基の多様性を活かした合成手法の開発(詳しくはこちら)
4)官能基化合成ユニットの開発(詳しくはこちら)
5)隣接トリカルボニル化合物を利用した合成反応の開発(詳しくはこちら)
6)求核的環変換反応による多官能複素環化合物の合成(詳しくはこちら)
7)置換基館反発を利用した芳香環の活性化(詳しくはこちら)
擬似分子内反応による高効率な反応の開発
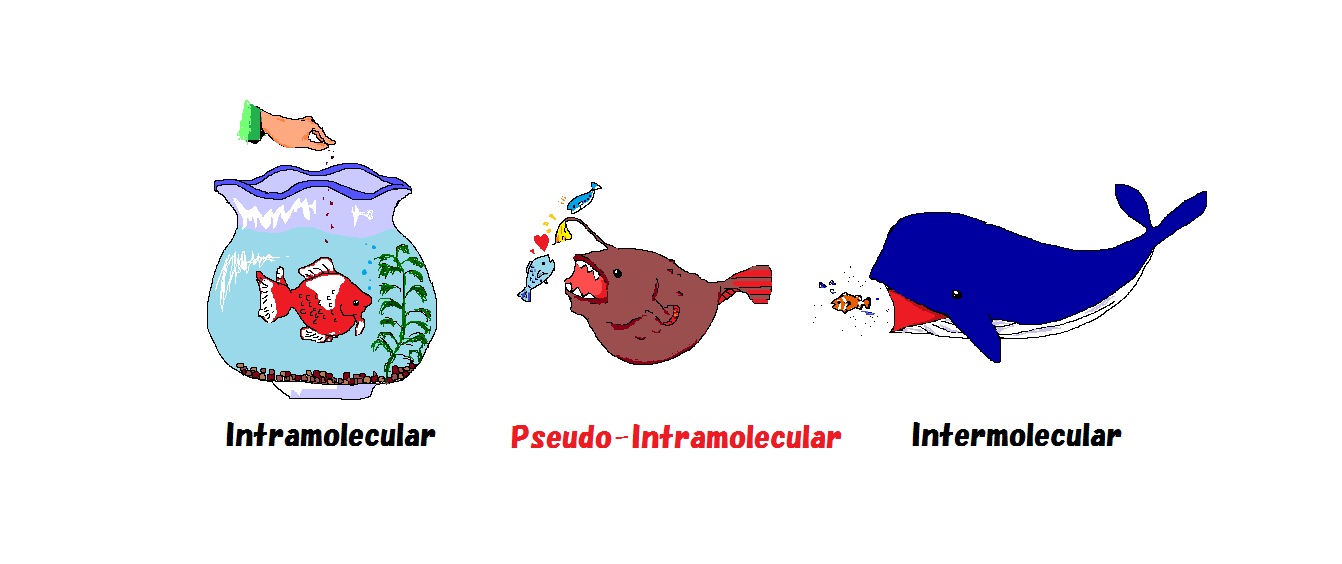
高効率な反応を開発することは、省資源、省エネルギーに繋がることから、環境負荷を軽減するために非常に重要です。通常の反応は分子間で進行しており、適度なエネルギーを持った2つの試薬が出会い、適切な角度で衝突する必要があります。それに対して分子内反応はその衝突頻度が高いために、分子間反応に比べて数千倍から数万倍速く進行します。例えるならば、分子間反応が広い海の中でえさを追い求めるクジラ型の反応であるならば、分子内反応は鉢の中で簡単にえさをもらえる金魚型の反応であると言えます。新しい概念「擬似分子内反応」に基づく合成手法も研究しています。それに対して、当研究室で開発した「擬似分子内反応」は酸性度の高い水素で反応させる基質を近くに引きつけて反応を行ないますので、分子間反応でありながら分子内反応のように効率良く進行しますので、チョウチンアンコウ型の反応であると言えます。
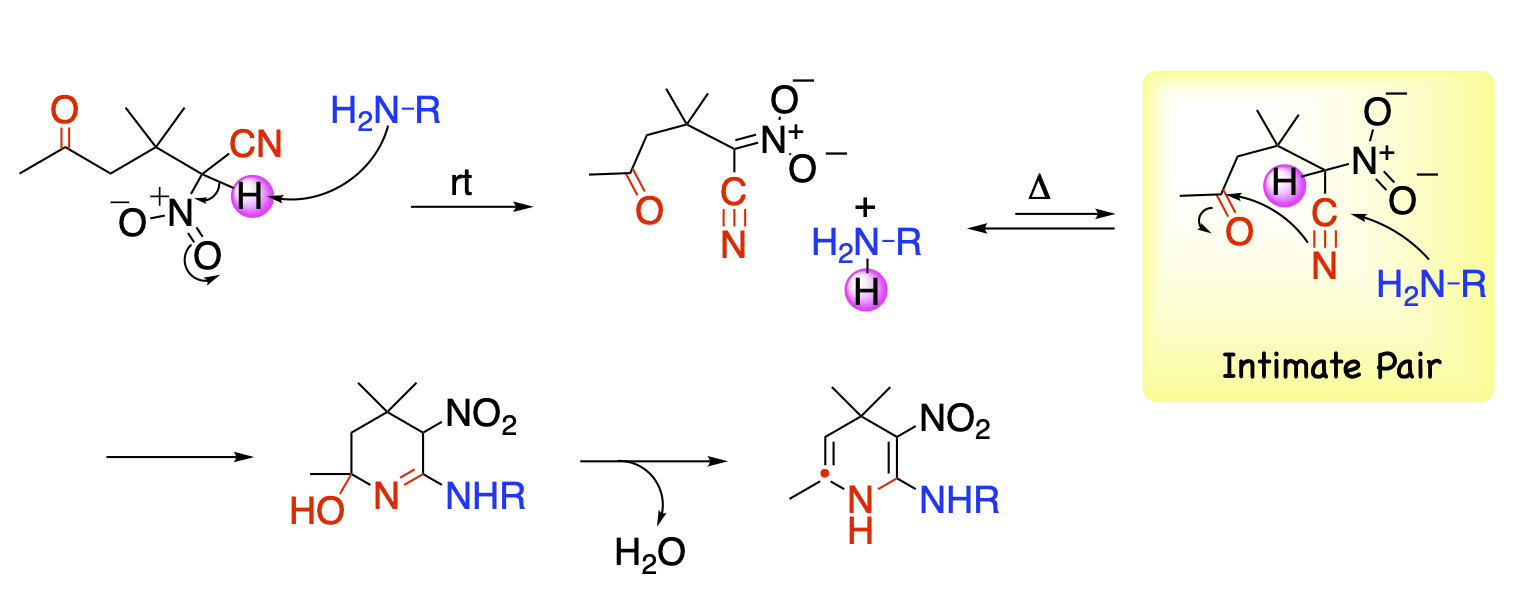
酸性度が高い水素と官能基を併せ持つ化合物が本反応の基質として働きます。このような条件を満たす化合物の分子設計や合成は比較的容易です。α-ニトロ-δ-ケトニトリルもその条件を満たす化合物であり、アミンを作用させると即座に塩を形成します。この塩を加熱すると、平衡によりアミンが遊離しますが求核剤であるアミンと求電子剤であるケトニトリルが近くに位置するため、アミンが近くにあるシアノ基次いでカルボニル基を連続して攻撃してアミノ基とニトロ基が隣接位に置換した1,4-ジヒドロピリジンが得られます。
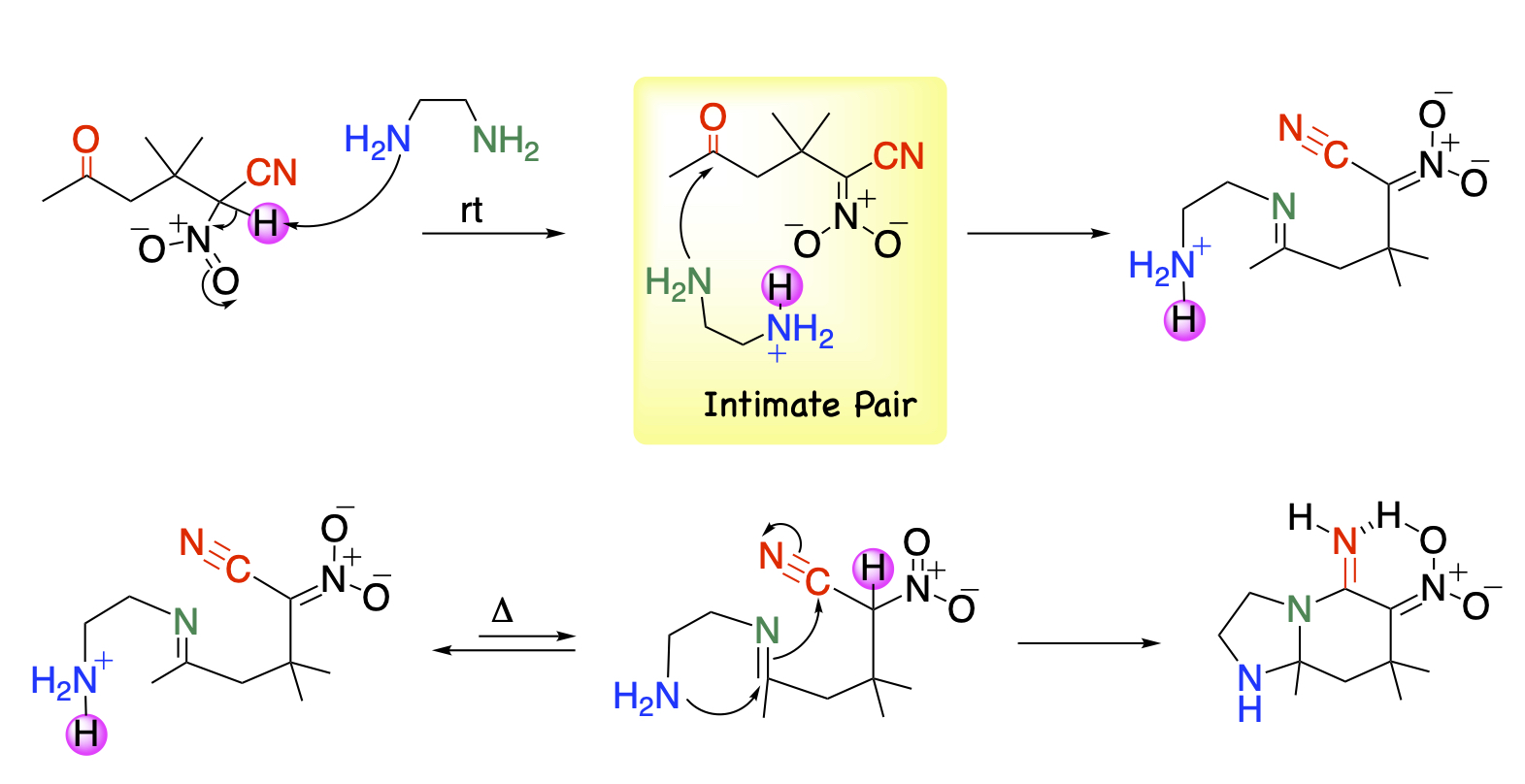
一方、ジアミン類を作用させますと、イミンを効率良く形成した後、遊離したもう1つのアミノ基がイミノ基炭素、次いでシアノ基を連続して攻撃することによりジアザビシクロ骨格を容易に構築します。
本概念の反応を用いれば、他法では入手が困難な多官能化合物を合成できるだけでなく、反応試剤を近傍に引き寄せるので、副反応が抑制され効率良く進行します。
Eur. J. Org. Chem. (2021)
Eur. J. Org. Chem. (2019)
Synthesis (2016)
Tetrahedron (2014)
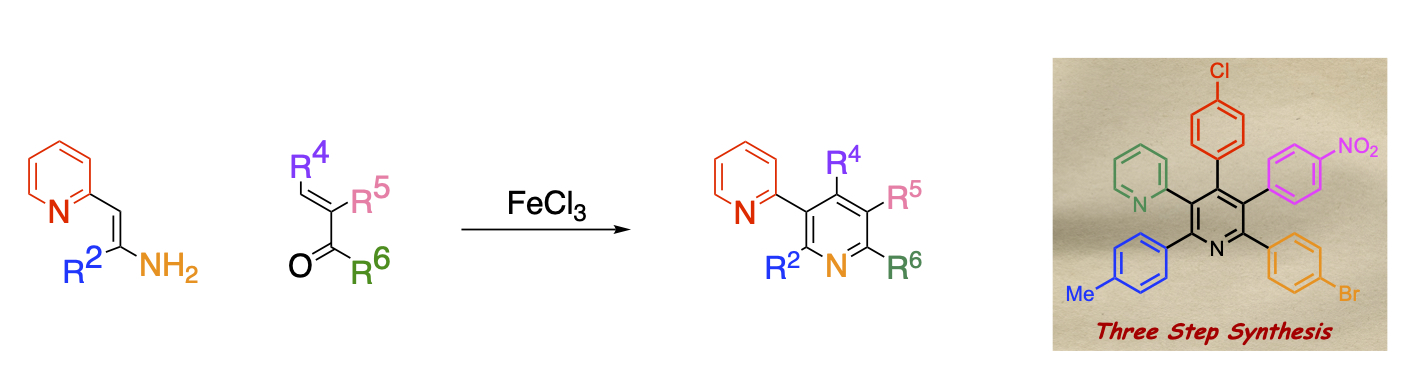
簡便な多置換ピリジン合成法の開発
ピリジン骨格は各種機能性物質の基本骨格としてしばしば見られますが、ピリジン環が反応性に乏しいために置換基を導入することが難しく、単純な骨格であっても新規化合物であることも多々あります。特にアルキル基やアリール基を導入することは容易ではありません。従って、望む置換基を望む位置に導入する簡便な方法を開発することは重要な課題の1つになっています。
当研究室では、電子供与基と電子求引基を併せ持ち、二重結合の電子密度に偏りを有するエナミノエステルとα,β-不飽和カルボニル化合物を塩化鉄の共存下で加熱すると、縮合反応が進行して多置換ニコチン酸エステルが得られることを明らかにしました。本反応の特長は基質のエナミノエステルや不飽和カルボニル化合物を替えるのみでピリジン環の修飾を容易に行なえることです。この特長を活かして、エステル官能基と隣接位のベンゼン環との間で縮合を行なえば、強い生理活性を示すオニシンやその誘導体を得ることもできます。
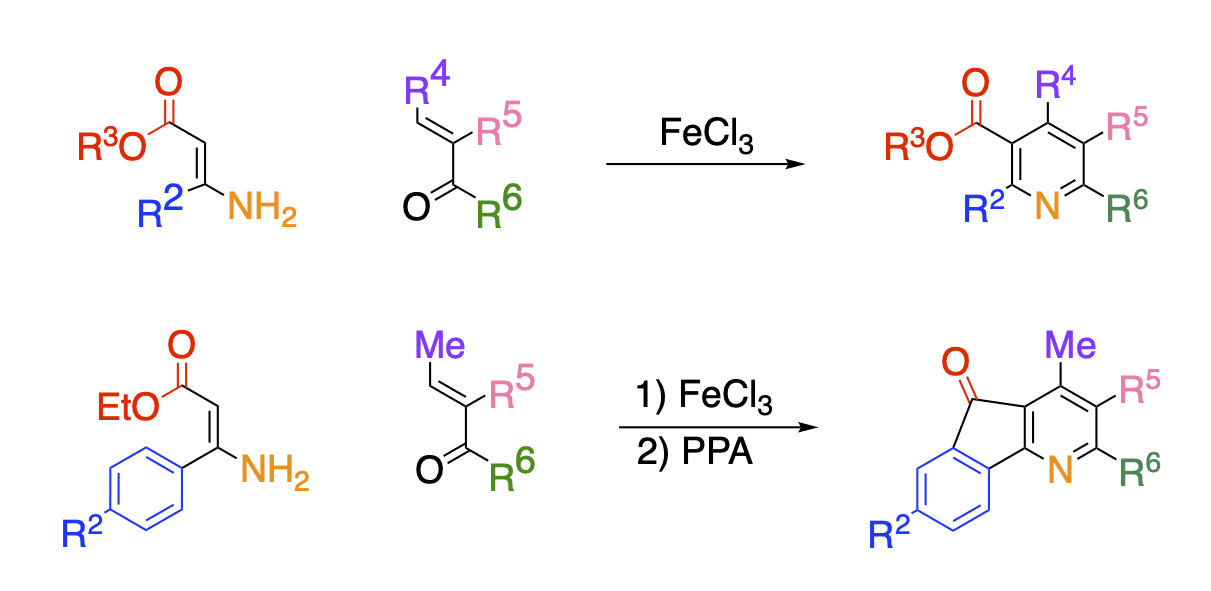
エステル官能基の代わりにピリジル基を有するエナミンを用いることも可能です。全ての位置に異なった芳香環が置換したピリジンを合成するには多段階を必要としていましたが、本法を用い流ことにより原料合成の段階も含めて3段階で合成することにことに成功しました。
Recent Publications
Eur. J. Org. Chem. (2020)
Synthesis (2019)
Chem. Commun. (2017)
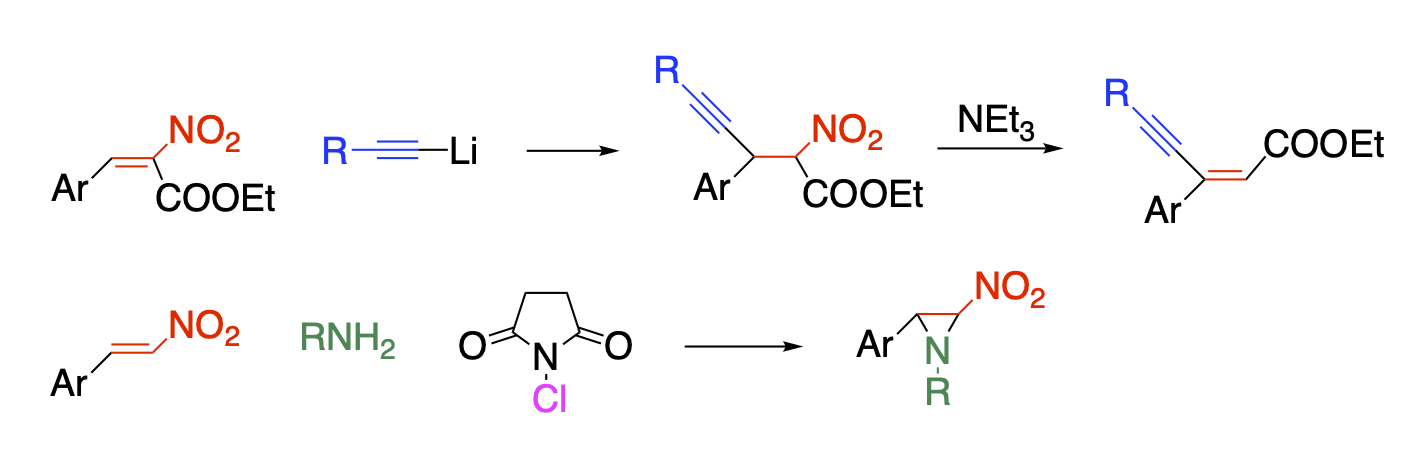
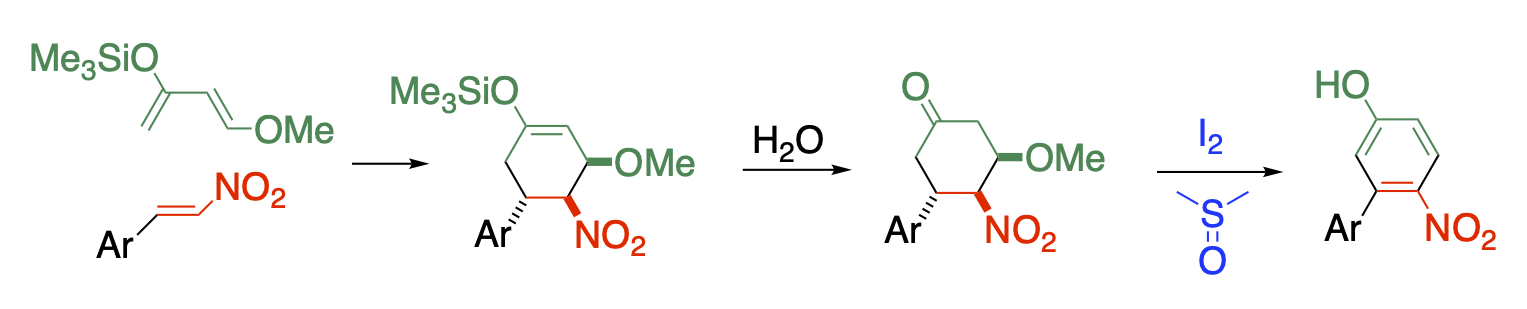
ニトロ基の多様性を活かした合成手法の開発
ニトロ基は誘起効果と共鳴効果の両方で強力に電子求引性を示し、結合している骨格の電子密度を下げて求核試薬との反応性を高めるだけでなく、α位の水素の酸性度を高めます。また、脱プロトン化したニトロナートイオンは求核試薬とも求電子試薬とも反応するという二面性を示し、多様な反応性を発現する原動力になっています。ニトロ基は脱離性にも優れており、直接的な置換は元より、隣接位の水素とともに亜硝酸として脱離して二重結合を生成します。さらにニトロ基を化学変換すれば他の官能基を有する化合物に誘導することができますし、ニトロ基を有うする骨格自体も生理活性を示すものがあります。これらの多様な反応性を組み合わせることにより、多官能化合物を合成することが可能になります。
ニトロアルケンはこのような用途に用いる基質として適しており、Michael付加した後に脱亜硝酸すればβ位の修飾が可能になりますし、求電子試薬を共存させれば隣接位を同時に官能基化が可能です。また、Diels-Alder反応により、多置換ベンゼンを合成することもできます。
Recent Publications
Beilstein J. Org. Chem. (2020)
Molecules (2020)
J. Org. Chem. (2018)
Org. Lett. (2017)
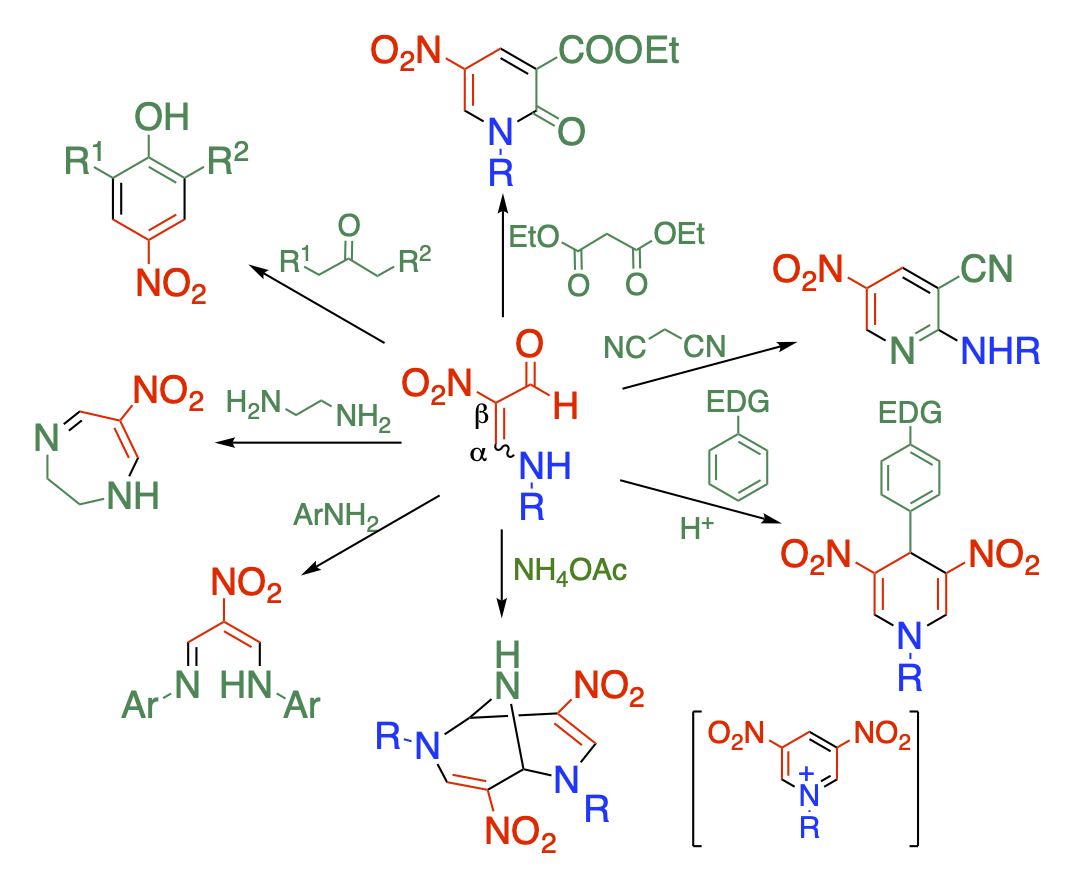
官能基化合成ユニットの開発
多官能化合物を合成する方法はいくつかありますが、官能基を有する合成ユニットを組み込むという手法があります。当研究室ではいくつかのユニットを開発し、合成反応に利用しています。
ニトロ基、ホルミル基、アミノ基を併せ持つホルミルニトロエナミンは、多官能性を有し多様な反応性を示します。この構造的特徴を活かして多岐に亘る骨格に誘導しています。すなわち、2個の求核部位を有する試薬を作用させれば、ニトロ基が置換した5員環のピラゾール、6員環のピリミジン、7員環の字畔ピン骨格を得ることができます。また、求核部位と求電子部位を併せ持つ試薬を作用させれば、多官能ピリドンやアミノピリジンが生成します。また、自己縮合すればジニトロピリジニウムイオンやビシクロ骨格を構築することも可能です。
Recent Publications
Org. Biomol. Chem. (2020)
Russ. Chem. Bull. Int. Ed. (2016)
RSC Adv. (2015)
ニトロイソオキサゾロンのピリジニウムイオンはアニオン性であるにも拘らず、塩基の作用で容易に開環しシアノアシニトロ酢酸塩を与えることを見出しました。この化合物はジアニオン性と多官能性を有していますので、カルボニル化合物や不飽和カルボニル化合物と反応してイソオキサゾールやナフチリジン骨格を与えます。この時、シアノアシニトロ酢酸塩は爆発性のニトロアセトニトリルの代替試薬として利用することができます。さらに酸性条件下で1,3-双極子として働き環化付加することも見出しています。
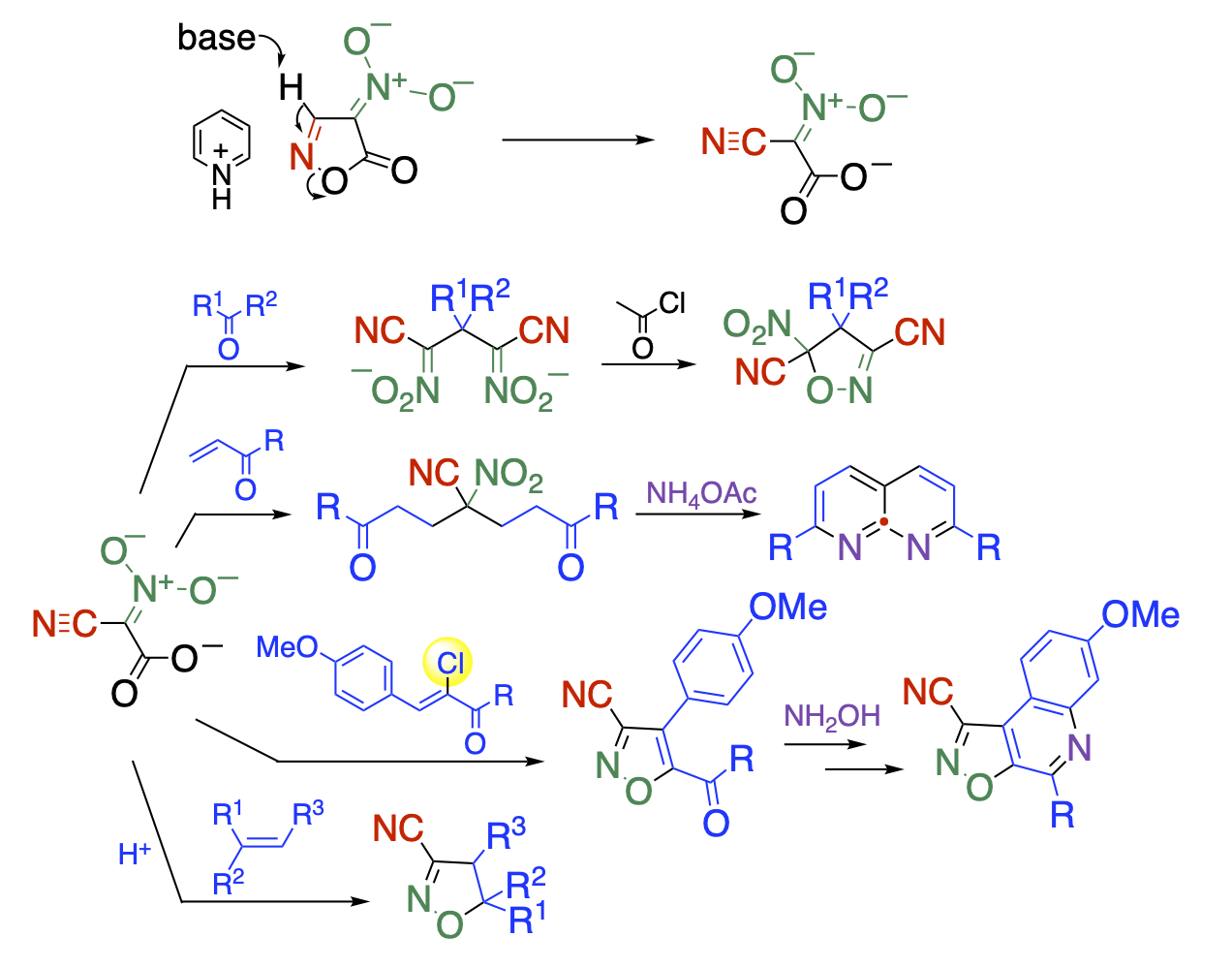
Recent Publications
J. Org. Chem. (2021)
Chem. Commun. (2019)
Curr. Med. Chem. (2017)
J. Org. Chem. (2017)
一方、N-メチルニトロイソオキサゾロンは水の作用で容易に開環しカルバモイル基を有するニトリルオキシドを発生します。アルケン、アルキンだけでなく、電子豊富なニトリル類とも環化付加することを明らかにしました。また、活性メチレン化合物はマグネシウムでキレート錯体を形成してエノール型に固定することにより環化付加することに成功しました。こうして得られた環化付加体が有する官能基はN-メチルカルバモイル基に限定されていますが、トシル化すればWeinrebアミドのように働き、様々な官能基に変換することができます。結果的に、多様な官能基化ニトリルオキシドを発生させたことになります。
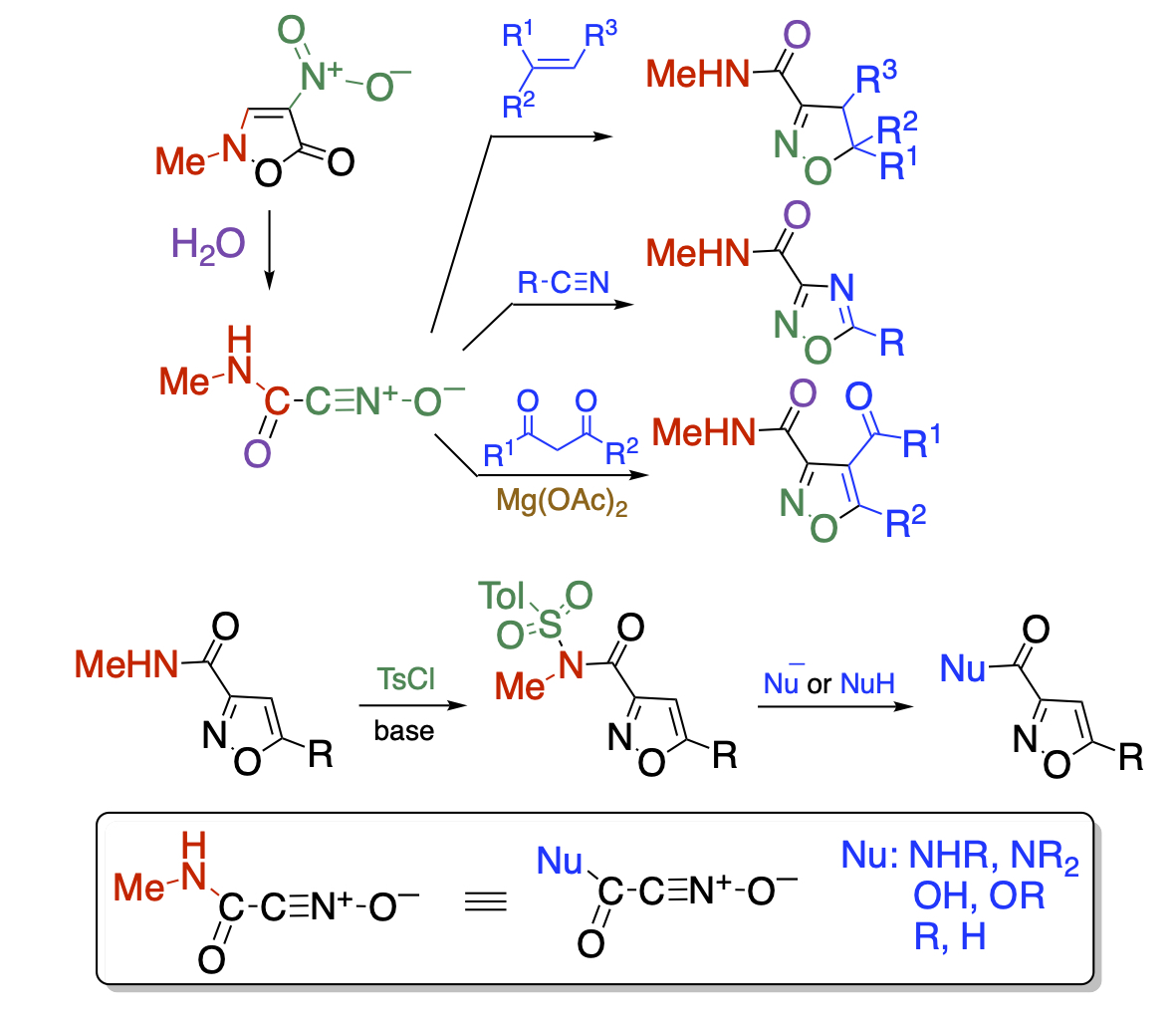
Recent Publications
Beilstein J. Org. Chem. (2015)
Methods and Applications of Cycloaddition Reactions in Organic Syntheses (2014)
Org. Bioorg. Chem. (2012)
隣接トリカルボニル化合物を利用した合成反応の開発
3つの連続したカルボニル基を有する化合物は高い反応性を有するとともに、多官能化合物を得るための合成ブロックとして有用です。当研究室ではクミアイ化学工業から製品化されているジエチルメソキサレート(DEMO)を用いた研究を展開しています。中央のカルボニル基は求電子性に富んでおり、酸アミドのような求核性の低い試薬と反応し、N,O-ヘミアセタールを与えます。本反応を無水酢酸中で行なえば、O-アセチル化も同時に行なうことができ、N,O-アセタールを1段階で得ることに成功しています。さらに塩基を作用させて脱酢酸すれば、より反応性に富むN-アシルイミンに変換できることも明らかにしました。
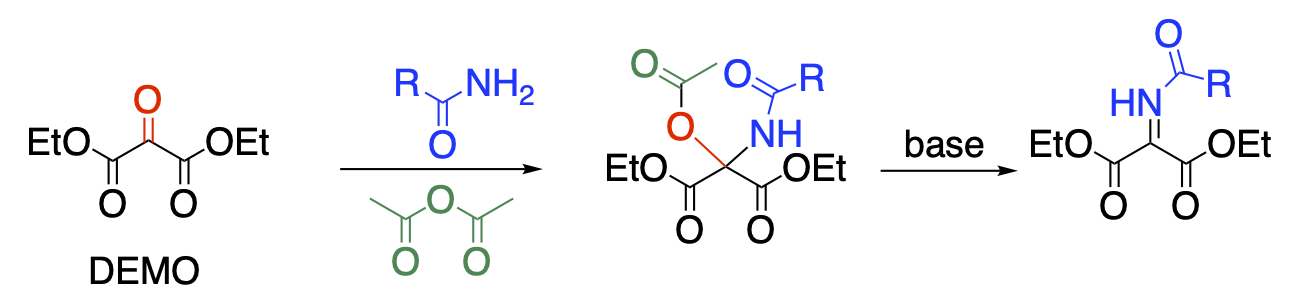
Recent Publications
Curr. Org. Chem. (2019)
Bull. Chem. Soc. Jpn. (2018)
Adv. Synth. Catal. (2016)
求核的環変換反応による多官能複素環化合物の合成
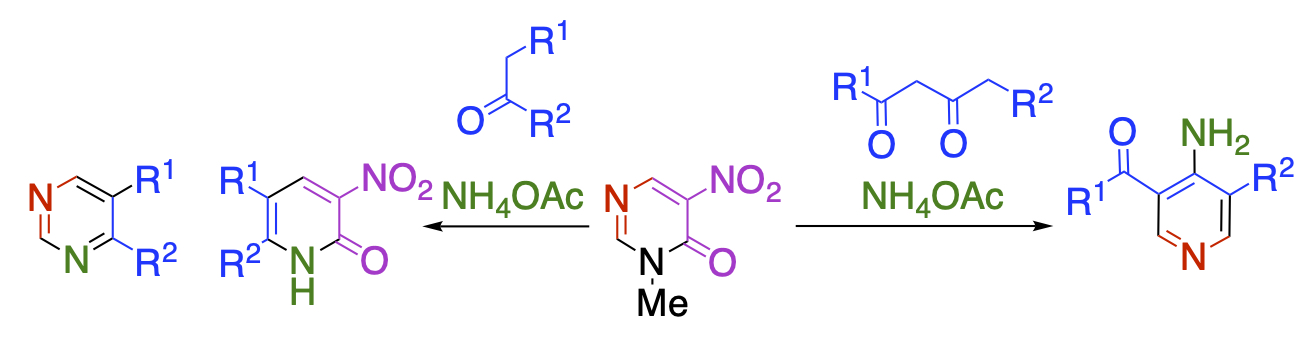
環変換反応とは、ある環骨格に試薬を作用ささせて、組み換えることにより新しい環骨格を構築する手法のことです。Diels-Alder型やDegenerate型の環変換反応は古くから盛んに研究されてきましたが、求核剤を作用させる求核型の環変換反応については、ほとんどなされていませんでした。当研究室では、ジニトロピリドンの構造的特徴に着目しました。すなわち、この化合物はニトロ基と環窒素とカルボニル基によって高度に電子不足になっているだけでなく、ニトロ酢酸アミドという良い脱離基を部分構造として有していますので、求核的な環変換反応の基質として適していると考えました。求核剤としてケトン、窒素源として酢酸アンモニウムを用いて反応を行なったところ、3成分系の環変換反応が進行し、他法では合成が困難な骨格を容易に得ることができることを明らかにしました。これら一連の反応では、ジニトロピリドンは超不安定試薬であるニトロマロンアルデヒドの安全な合成等価体として働いています。
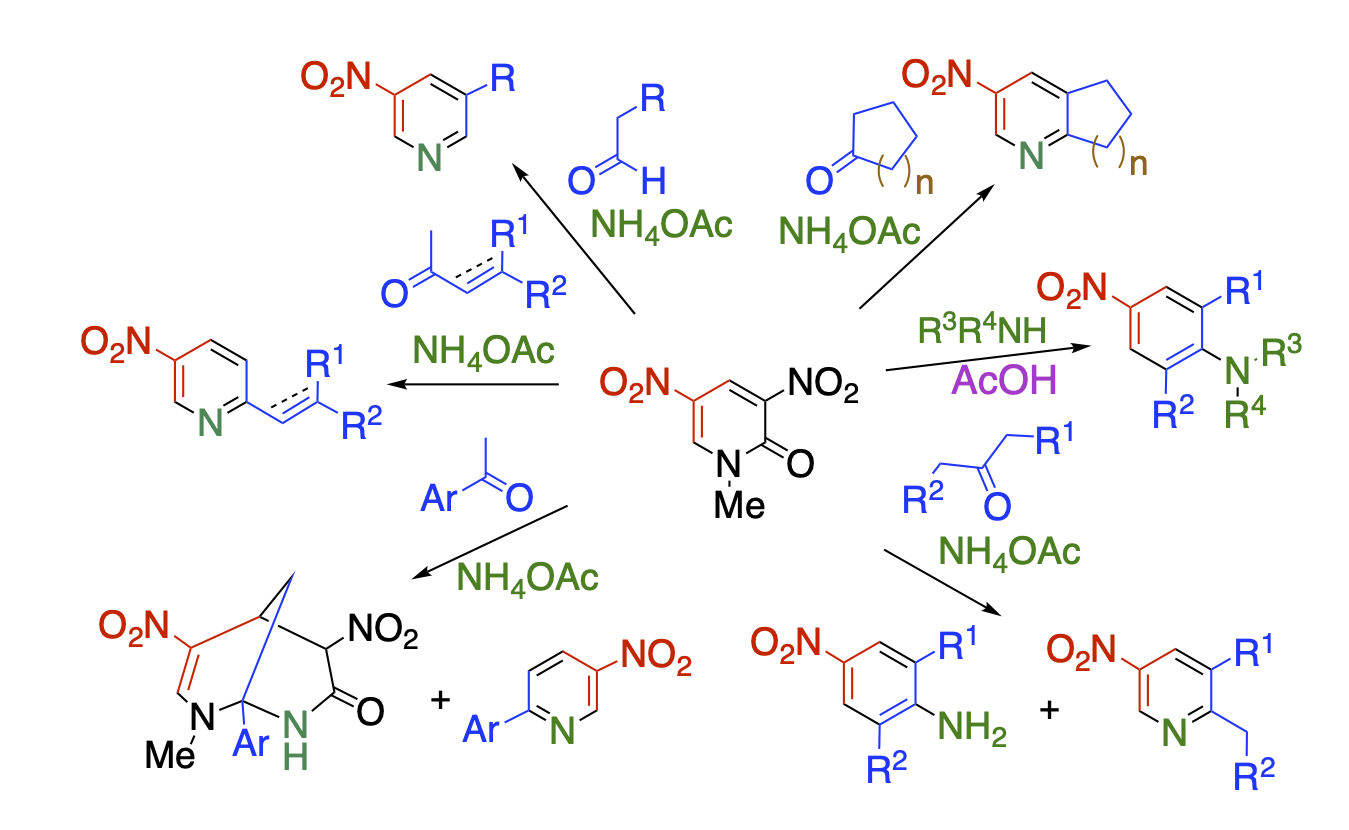
Recent Publications
有機合成化学協会誌 (2016)
J. Org. Chem. (2015)
Eur. J. Org. Chem. (2015)
ジニトロピリドンのニトロ基の1つを環窒素に置き換えたニトロピリミジノンも求核型の環変換反応の優れた基質として働きます。この場合、ピリミジノンは活性化されたジホルミルアミンやα-ニトロホルミル酢酸の合成等価体として働いています。
Recent Publications
Molecules (2021)
Tetrahedron Lett. (2013)
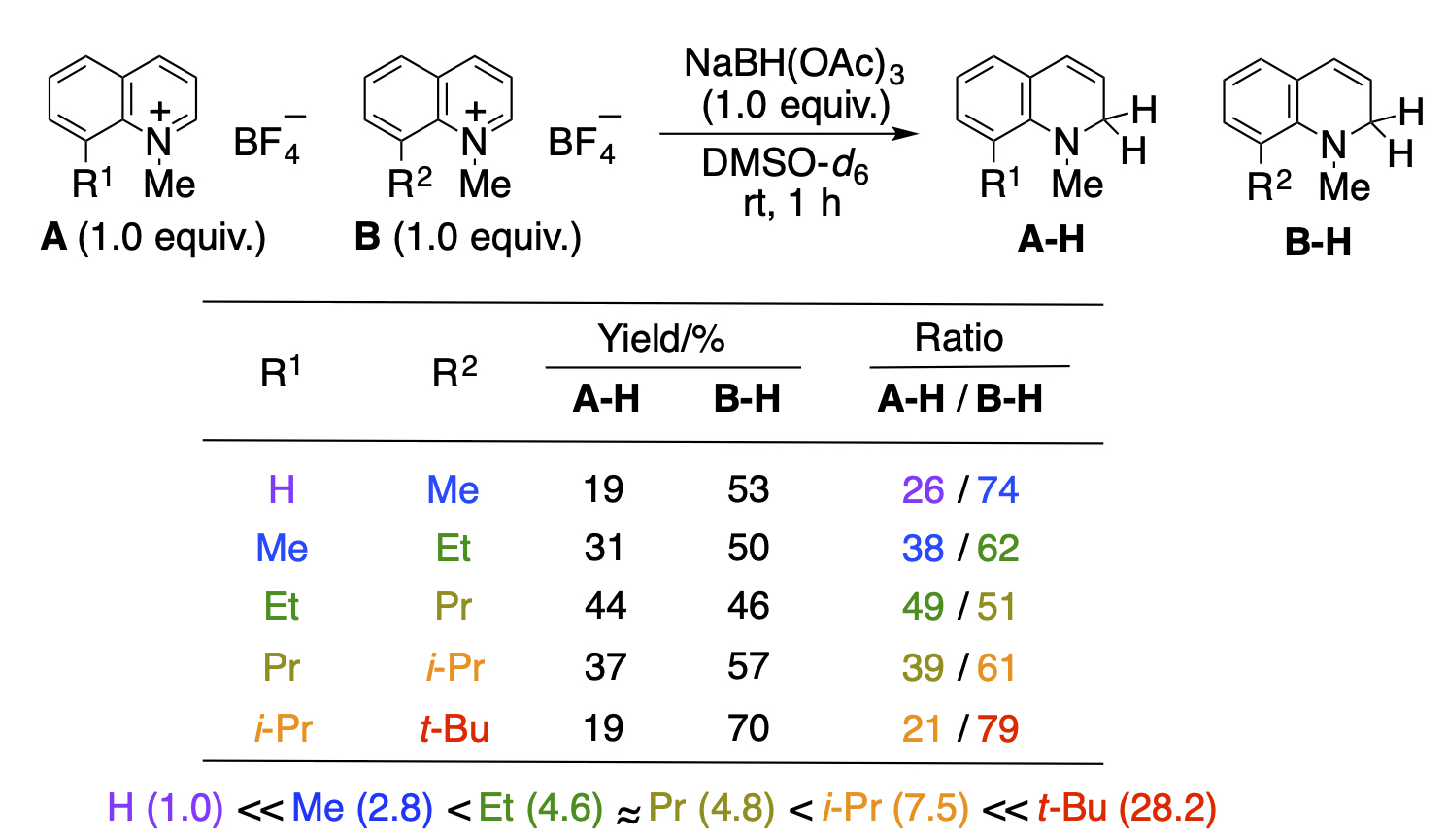
置換基館反発を利用した芳香環の活性化
芳香環は安定であるがために、修飾するためには芳香族性を崩す必要があります。一般には、置換基による電子的な影響で活性化したり、ハロゲンを導入して炭素ーハロゲン結合を利用した修飾をしたりしています。当研究室では、置換基間の単純な立体反発が共平面性を崩して芳香族安定化が低下するとの考えに基づいて検討を行ないました。実際に1-メチルキノリニウム塩の8位に様々な大きさのアルキル基を導入して比較しましたところ、嵩高い置換基を導入すればするほど、共平面性が崩れ、反応性が高くなることを明らかにしました。
Recent Publications
Bull. Chem. Soc. Jpn. (2020)
Tetrahedron (2013)